Termijn voor opname van innovatieve geneesmiddelen in de lijst van vergoedbare farmaceutische specialiteiten: een gedetailleerd overzicht
Voor patiënten is het van cruciaal belang om snel toegang te krijgen tot de geneesmiddelen die ze nodig hebben. Een van de belangrijkste taken van het RIZIV hierin is het beheren van de processen die deze toegang mogelijk maken (in de vorm van vergoeding). Hierdoor streeft het RIZIV er voortdurend naar om de vergoedingsaanvragen snel, efficiënt en kwalitatief af te handelen, in overeenstemming met wettelijk vastgestelde procedures.
In een context waarin snelle toegang tot innovatieve geneesmiddelen essentieel is voor de volksgezondheid, onderscheidt België zich van zijn Europese buurlanden door zijn eigen vergoedbaarheidsprocedures voor alle vergoedbare geneesmiddelen, zowel in openbare apotheken als in ziekenhuizen.
We willen een meer gedetailleerd overzicht geven van de termijnen voor opname van innovatieve geneesmiddelen in de lijst van vergoedbare farmaceutische specialiteiten in België, vanaf het verkrijgen van de marktvergunning door het Europees Geneesmiddelenbureau (EMA) tot de vergoeding.
Op deze pagina:
Hoe lang duurt het voordat innovatieve geneesmiddelen worden opgenomen in de vergoedbaarheid in België?
Elk jaar analyseren we de termijnen voor de opname van geneesmiddelen in de lijst van vergoedbare farmaceutische specialiteiten in België.
Van de 167 geneesmiddelen die EFPIA heeft geanalyseerd in het rapport W.A.I.T. (Waiting to Access Innovative Therapies)-indicator 2023, hadden we op 01/07/2024 een vergoedingsaanvraag ontvangen voor maar 126 geneesmiddelen een vergoedingsaanvraag ontvangen. Van deze aanvragen zijn:
- 83 geneesmiddelen (66%) goedgekeurd en vergoed
- 23 geneesmiddelen (18%) nog in de vergoedingsprocedure
- 10 geneesmiddelen (8%) hebben een negatieve beslissing ontvangen zonder dat de firma een nieuwe vergoedingsaanvraag heeft ingediend
- 2 geneesmiddelen (2%) zonder geldig dossier
- 8 dossiers (6%) door de firma zelf teruggetrokken


Overzicht van ingediende aanvragen bij het RIZIV
Na het verkrijgen van een marktvergunning kan de firma onmiddellijk een vergoedingsaanvraag bij het RIZIV indienen. Volgens de gegevens bedraagt de periode tussen het verkrijgen van de marktvergunning en de eerste ingediende vergoedingsaanvraag 131 dagen.

De procedure tussen een vergoedingsaanvraag en de opname in de lijst van vergoedbare farmaceutische specialiteiten duurt ongeveer 383 dagen. Deze periode van 383 dagen omvat de analyse van de aanvragen, de schorsingen van deze procedures door de administratie vanwege de onontvankelijkheid van het dossier (± 4 dagen) en de schorsingen aangevraagd door de firma in reactie op de evaluatierapport of voorlopig voorstel van de Commissie tegemoetkoming geneesmiddelen (± 65 dagen). Daarnaast omvat deze periode ook de tijd die nodig is voor onderhandelingen met de firma’s in het geval van vergoeding onder contract (± 42 dagen), evenals de tijd tussen de notificatie van de positieve beslissing en de inwerkingtreding ervan, inclusief de publicatie in het Belgisch Staatsblad (± 45 dagen), wat tot maximaal 60 dagen kan bedragen.

De periode tussen de marktvergunning en de eerste vergoeding bedraagt gemiddeld 575 dagen.
De WAIT-indicatoren van EFPIA
De EFPIA (de Europese federatie van de farmaceutische industrie en verenigingen) voert jaarlijks een onderzoek uit naar de snelheid waarmee een geneesmiddel wordt geïntegreerd in de ziekteverzekeringen. Hiervoor selecteren ze telkens een gelimiteerd aantal geneesmiddelen en een tijdsperiode. De gegevens die worden gebruikt om de waarden per land te bepalen, worden verstrekt door de industrie zelf en niet door de instellingen die verantwoordelijk zijn voor de vergoeding van medicijnen. Dit rapport kan je lezen op de website van EFPIA.
In het rapport 2023 (WAIT-indicator) heeft EFPIA 167 geneesmiddelen onderzocht. De snelheid van vergoedbaarheid van deze geneesmiddelen varieert aanzienlijk tussen verschillende Europese landen. Volgens EFPIA scoort België rond het Europese gemiddelde. Van de geselecteerde geneesmiddelen zijn er 76 vergoed (gemiddelde EU: 72) met een gemiddelde wachttijd tussen de goedkeuring en de vergoeding in België van 565 dagen (Gemiddelde voor EU: 531 dagen).
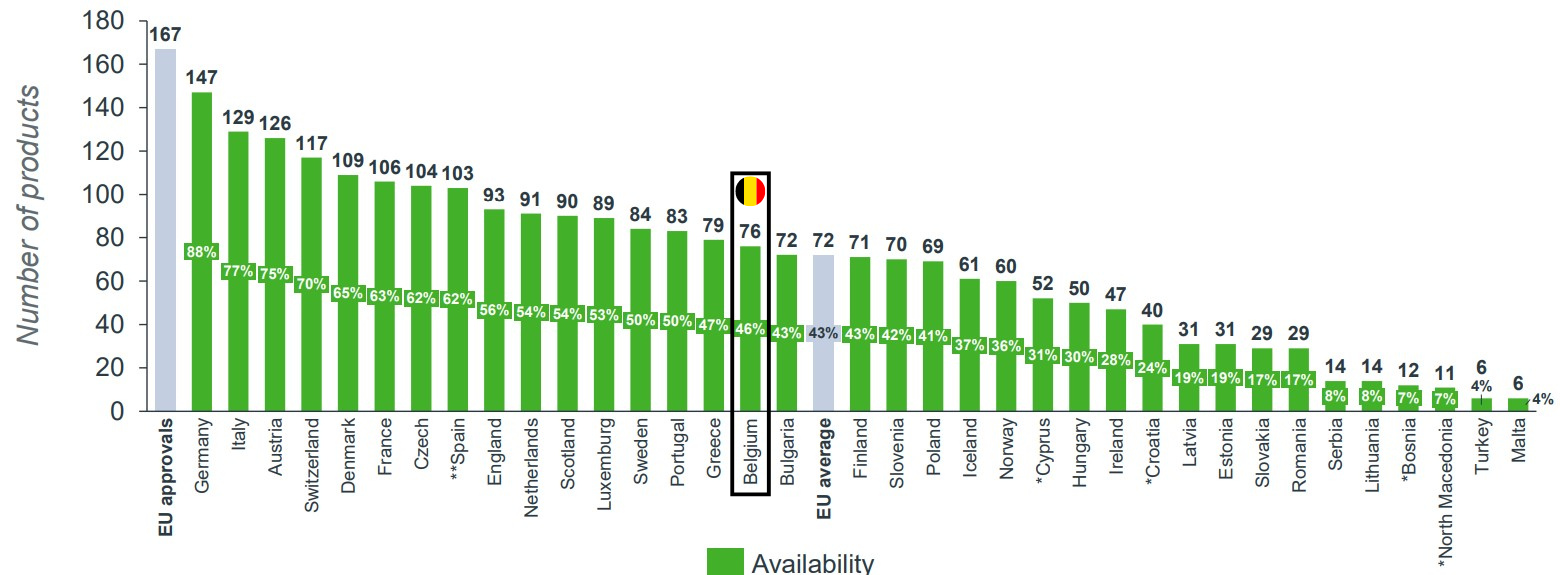
Source : EFPIA WAIT indicator survey 2023 (juni 2024) – status op 05/01/2024
Op 01/07/2024 vergoedde België niet 76 maar 83 medicijnen, rekening houdend met het gegeven dat van de 167 medicijnen slechts 126 aanvragen zijn ingediend. Dit toont aan dat België boven het EU-gemiddelde ligt, als we de gegevens van het RIZIV van 01/07/2024 vergelijken met de gegevens uit het EFPIA-rapport van 05/01/2024.
Het RIZIV zet zich in en zal zich blijven inzetten om de dossiers op een kwalitatieve en efficiënte manier te behandelen, zodat patiënten zo snel mogelijk de beste zorg kunnen ontvangen. Het leveren van hoogwaardige zorg aan patiënten is en blijft onze hoogste prioriteit.
Hoe wordt een geneesmiddel opgenomen in de vergoeding?
Voordat een geneesmiddel in België kan worden vergoed, moet het verschillende stappen doorlopen:
- Verkrijgen van de vergunning voor het in de handel brengen (VHB)
Het geneesmiddel krijgt een VHB, uitgegeven door het Europees Geneesmiddelenbureau (EMA) of het Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten (FAGG). - Prijsbepaling
De prijs van het geneesmiddel wordt vastgesteld door de Minister van Economische Zaken. - Aanvraag voor opname in de lijst van vergoedbare specialiteiten
De firma dient een vergoedingsaanvraag in bij de Commissie Tegemoetkoming Geneesmiddelen (CTG). - Evaluatie van de aanvraag
De CTG evalueert de aanvraagdossier op basis van de beschikbare wetenschappelijke en economische gegevens en formuleert een advies. - Eindbeslissing van de minister
De Minister van Sociale Zaken neemt binnen 180 dagen na ontvangst van de volledige aanvraag een beslissing over het al dan niet opnemen van het betrokken farmaceutische specialiteit op de lijst van vergoedbare specialiteiten.
Meer informatie
Contacten
Reglementering geneesmiddelen
E-mail: secr-farbel@riziv-inami.fgov.be